Clostridium difficile est une bactérie de type bacille gram positif anaérobie stricte, sporulée et productrice de souches toxinogènes responsables de diarrhées sévères.
Le mécanisme est complexe, essentiellement lié à l’action de deux toxines : A « entérotoxines» et B « cytotoxines» produites par les spores. Elles altèrent la composition du microbiote intestinal et favorisent l’implantation de la bactérie au niveau colique. Cette perturbation de la flore permet aux souches toxinogènes de coloniser l’intestin. L’effet pathogène de cette bactérie n’a été mis en évidence qu’à la fin des années 1970 suite à la publication du premier modèle animal après injection d’antibiotique in vivo.
Dès lors, l’intérêt porté à cette bactérie n’a cessé de croitre en raison de l’augmentation de la consommation des antibiotiques, principal facteur de risque rapportée dans la littérature et des progrès réalisés en matière de diagnostic bactériologique. Parmi les autres facteurs de risques, comme la plupart des agents à transmission manuportée, la promiscuité des patients favorise l’infection à Clostridium difficile (ICD), l’âge (> 65 ans), la présence de comorbidités (une insuffisance rénale, ou une immunodépression), la sévérité de la maladie initiale, la prise d’antiacides, les ralentisseurs du transit, les lavements répétés, la chirurgie digestive et l’alimentation artificielle par voie entérale sont des facteurs supplémentaires [1].
Il existerait environ 20 % de patients colonisés asymptomatiques en milieu hospitalier et 3 % en ville. L’ICD serait responsable de 10 à 25 % des diarrhées sous antibiotiques et de plus de 95 % des colites pseudomembraneuses [1]. C’est aussi la première cause de diarrhée nosocomiale (12,1% des IAS aux Etats Unis, 5,4% en Europe) [2]. Il est décrit des épidémies dans des élevages de porcins et volailles mais aussi la mise en évidence de CD dans les viandes, légumes, coquillages [3], posant la question d’une transmission humaine par l’alimentation.
Depuis le début des années 2000, les ICD sont plus fréquentes avec une incidence multipliée par 3 à 8 en Amérique du Nord. Elles sont plus sévères avec un taux de mortalité variable passant de 5 % en 1990 à 13,8 % en 2007. Le risque de complication est à présent de 18,2 %. Elles sont le plus souvent réfractaires aux traitements standards, avec un échec du métronidazole (9,6 % vs 25,7 %) et une augmentation des récidives chez les patients âgés de plus de 65 ans (28,9 % vs 58,4 %) [4].
Les données nord-américaines et européennes indiquent qu’environ 25% des cas d’ICD sont d’origine communautaire, avec une incidence moyenne en augmentation depuis 20 ans de 20-40 cas pour 100 000 habitants [5]. Une ICD est dites communautaire lorsque présente à l’admission du patient ou survenant dans les 48 heures après l’admission et en l’absence d’antécédents d’hospitalisation dans les 12 semaines précédentes. Au contraire de l’ICD nosocomiale survenant après 48 d’hospitalisation ou dans les 4 semaines suivant la sortie de l’hôpital (Figure 1).
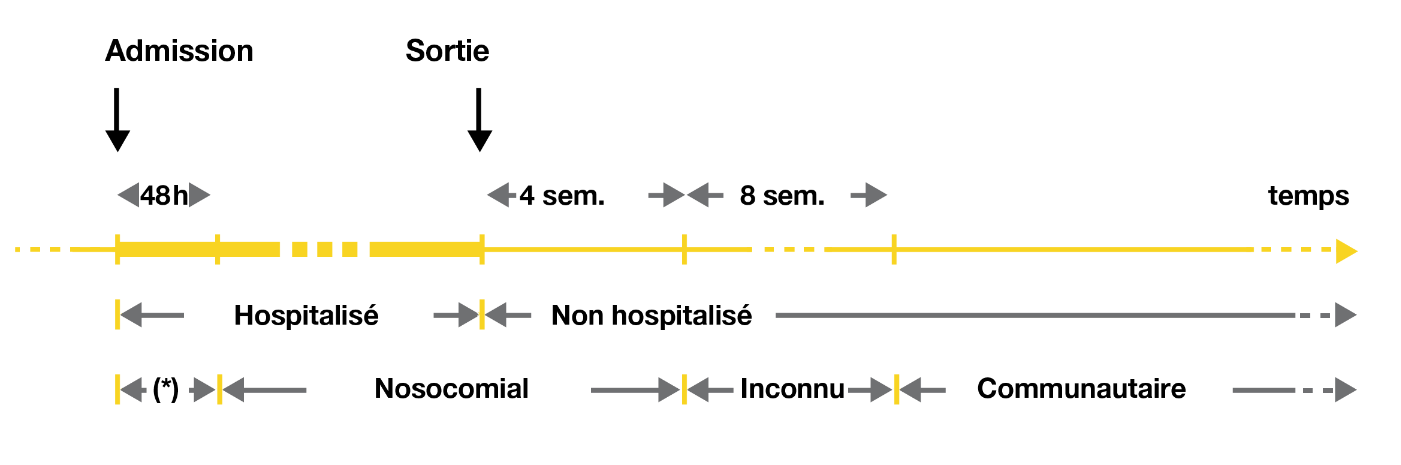
Figure 1 : Schéma conceptuel de l’ICD communautaire et nosocomial – McDonald LC, et al. ICHE 2006;28:140-6
De nombreuses études ont suggéré une augmentation de l’incidence d’ICD communautaires chez des populations précédemment considérées à faible risque d’infection (enfant, femme enceinte). A l’hôpital, la fréquence de cas d’origine communautaire varie entre 25 et 40%. Une exposition aux antibiotiques dans les 3 derniers mois, a été observée chez seulement 40-61% des cas d’origine communautaire et surtout observées chez des personnes jeunes en bonne santé [6]. Les recommandations actuelles ne préconisent pas de rechercher systématiquement la présence de CD en sortie d’hospitalisation sans signes fonctionnels digestifs à type de diarrhées.
L’émergence et la diffusion rapide d’un nouveau clone particulièrement virulent, NAP1/027/BI, est à l’origine d’une épidémie qui a commencé à diffuser aux USA et Canada à partir de 2003, puis en Europe (figure 2). Cette souche particulière de CD est caractérisée par sa résistance à l’érythromycine et à certaines fluoroquinolones (moxifloxacine, lévofloxacine). Elle présente la particularité de produire, in vitro, respectivement 16 et 23 fois plus de toxines A et B que les souches de CD d’autres toxinotypes. De plus, cette souche se caractérise par une résistance croissante au traitement avec échecs thérapeutiques et formes récidivantes [7].
Face à l’émergence et à la dissémination de la souche 027, la surveillance et le signalement des ICD ont fait l’objet des recommandations du Réseau d’Alerte, d’Investigation et de Surveillance des Infections Nosocomiales (RAISIN). Ces recommandations ont été reprises et complétées par le Comité Technique des Infections Nosocomiales et des Infections Liées aux Soins (CTINILS) en septembre 2006 et le Haut Conseil de la Santé Publique en juin 2008 [8]. Elles ont également été accompagnées d’une sensibilisation des établissements de santé (ES) la même année. Cette surveillance des ICD repose sur un signalement externe des cas sévères et/ ou groupés.
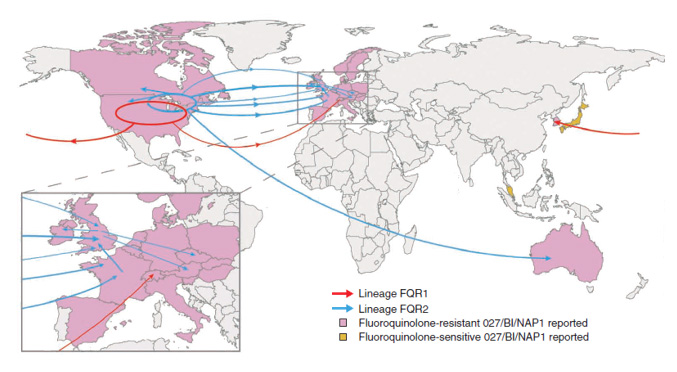
Figure 2 : Dissémination mondiale du clone Clostridium difficile 027/BI/NAP1 – Miao He, Fabio Miyajima, Paul Roberts, et al. Emergence and global spread of epidemic healthcare-associated Clostridium difficile. Nature Genetics.2013 ; 45, 109–113.
Il existe plus de 1200 souches de Clostridium difficile avec une très grande diversité de PCR-ribotypes recensées parmi les pays Européen avec une ICD pour 4,1/ 10,000 patient/jour, soit 1 infection toutes les 436 admissions (Figure 3). Même, si le ribotype 027 est le plus fréquent (18 %) la majorité des pays (14/16) a une grande variété de PCR-ribotype sans clone dominant. La fréquence du ribotype 078 a augmenté dans la communauté mais aussi au niveau des hôpitaux européens. A l’heure actuelle, aucune épidémie d’ICD communautaire n’a été décrite. Par contre, la forte fréquence de la souche 078 chez certains animaux ainsi que dans leur environnement immédiat peut être associée à une potentielle source zoonotique. Alors, l’augmentation des ICD en milieu vétérinaire est de ce fait une source d’inquiétude, en lien avec l’augmentation de l’exposition des animaux aux antibiotiques en raison de leurs conditions d’élevage. Cette contamination peut soulever des préoccupations en santé publique et des études sont nécessaires pour évaluer son impact dans la survenue d’ICD chez l’homme [10].
Les données recensées par « l’European Clostridium difficile infection surveillance network », mettent en évidence 4,1 ICD / 10,000 patient-jour, soit 1 infection toutes les 436 admissions hospitalières en Europe. Une inversion de l’axe traditionnel Nord-Sud, en lien avec une recherche beaucoup plus active d’ICD dans les pays du Nord de l’Europe (Figure 3) et un sous-diagnostic dans les pays du Sud de l’Europe [9]. En effet, l’enquête EUCLID a montré que la demande de recherche d’ICD sur une selle diarrhéique n’était réalisée en France que dans environ la moitié des cas, plus d’un tiers des laboratoires ne recherche CD que sur demande spécifique du clinicien, alors plus de 6000 ICD ne serait pas diagnostiquée en 1 an [11].
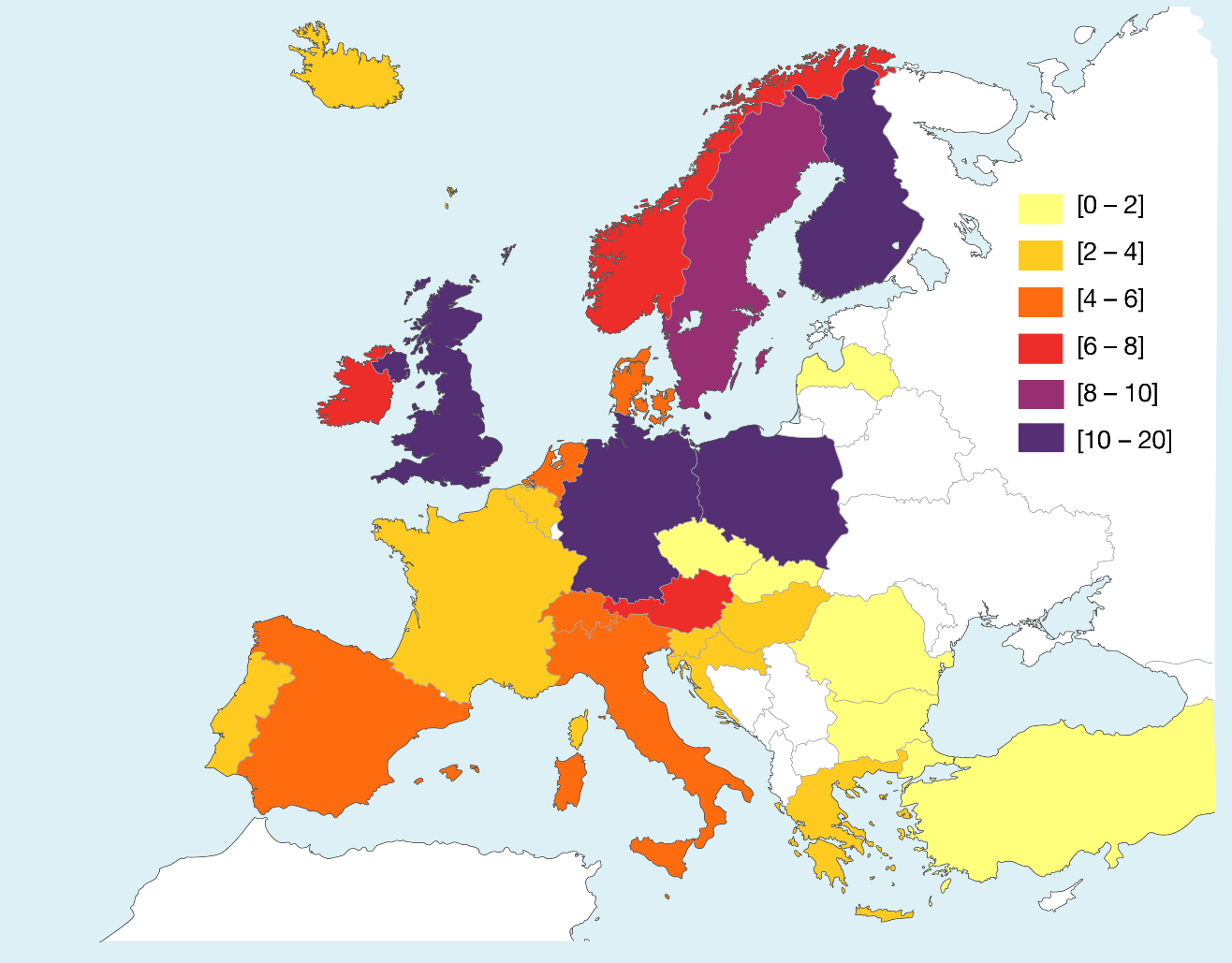
Figure 3 : Situation Européenne :ECDIS-2008 – axe Nord-Sud – Bauer MP, et al. Lancet 2011;377:63-73
L’impact économique hospitalier est immédiat avec une durée moyenne de séjour augmentée de 5 à 13,6 jours (médiane 7 j) en cas de diagnostic principal d’ICD. En gériatrie, la durée moyenne est augmentée de 36 jours. Le surcoût estimé à 9 024 euros en 2012 en Franc prend en compte les couts directs liés à la prise en charge médicale, le traitement antibiotique, les tests diagnostiques etc. et les coûts de mesure d’hygiène et de prévention [12]. Les projections de dépenses de soins liées à l’ICD sont liées au vieillissement de la population, avec un coût estimé à 3 milliards d’euros/an en Europe et près de 5 milliards de dollars/an aux Etats-Unis (Figure 4) [13]. Le taux de mortalité est, pour les formes les moins graves, entre 0,6 et 3 %, mais peut approcher 50 % en présence de complications. Chez les patients âgés de plus de 80 ans, la mortalité représente près de 15 % malgré un traitement bien conduit [14].
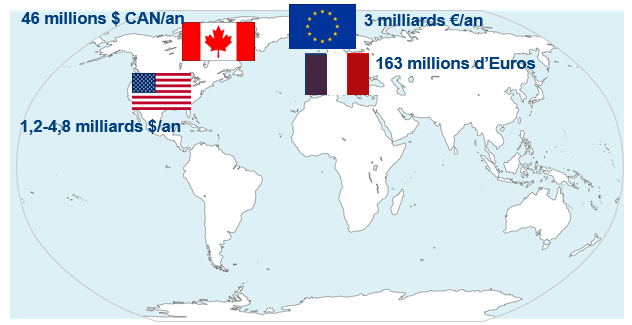
Figure 4 : Projections économique des infections à Clostridium difficile
[1] Debast SB, Bauer MP, Kuijper EJ. Committee European Society of Clinical Microbiology and Infectious Diseases : update of the treatment guidance document for Clostridium difficile infection, Clin Microbiol Infect. 2014 ;20 :1–26.
[2] Magill SS, Edwards JR, Bamberg W, Beldavs ZG, Dumyati G, Kainer MA, et al. Multistate point-prevalence survey of health care-associated infections. N Engl J Med. 2014 ;370 :1198–208.
[3] J. Glenn Songer, Hien T. Trinh, George E. Killgore, and al Clostridium difficile in Retail Meat Products, USA, 2007. Emerging Infectious Diseases. 2009 ;15 819-821.
[4] Ducasse V, Vu Xuan Chi S, et al. Point sur l’émergence des infections récidivantes à Clostridium difficile chez le sujet âgé. NPG. 2014;14 :26–31.
[5] Eckert C, Barbut F. [Clostridium-difficile-associated infections]. Med Sci (Paris) 2010, 26(2):153-158.
[6] Doan L, Forrest H, Fakis A, Craig J, Claxton L, Khare M. Clinical and cost effectiveness of eight disinfection methods for terminal disinfection of hospital isolation rooms contaminated with Clostridium difficile 027. J Hosp Infect. 2012 ;82(2) :114-21.
[7] Marsh JW, Arora R, Schlackman JL, et al. Association of Relapse of Clostridium difficile Disease with BI/NAP1/027. J Clin Microbiol 2013, 50(12) :4078-4082.
[8] Haut Conseil de la Santé Publique. Avis relatif à la maîtrise de la diffusion des infections à Clostridium difficile dans les établissements de santé français. 2008.
[9] Bauer MP, Notermans DW, van Benthem BH et al. Clostridium difficile infection in Europe : a hospital-based survey. Lancet 2011;377 :63–73
10 Rodriguez C, Taminiau B, Van Broeck J, Delmee M, Daube G. Clostridium difficile in Food and Animals: A Comprehensive Review. Adv Exp Med Biol – Advances in Microbiology, Infectious Diseases and Public Health DOI 10.1007/5584_2016_27
[11] Barbut F, Presse médicale, 2014
[12] Wiegand PN, Nathwani D, Wilcox MH, et al. Clinical and economic burden of Clostridium difficile infection in Europe : a systematic review of healthcare-facility-acquired infection. J Hosp Infect. 2012 May;81(1) :1 14
[13] Kuijper EJ, van den Berg RJ, Debast S, Visser CE, Veenendaal D, Troelstra A, et al. Clostridium difficile ribotype 027, toxinotype III, the Netherlands. Emerg Infect Dis 2 006 May ;12(5) :827-30.
[14] Louie TJ, Miller MA, Crook DW, et al. Effect of age on treatment outcomes in Clostridium difficile infection. J Am Geriatr Soc 2013 ; 61:222–30
